La encefalopatía hipóxico-isquémica perinatal o EHI, es el compromiso agudo de la función cerebral (encefalopatía) que se instala en un recién nacido a raiz de un evento que genera una falla en la oxigenación de los tejidos (hipoxia), por ejemplo un desprendimiento de placenta. Cuando la hipoxia se mantiene en el tiempo el descenso del pH resultante genera una falla en la función de bomba del corazón y como consecuencia una disminución del flujo sanguíneo cerebral (isquemia). De todo este proceso proviene su denominación: Encefalopatía Hipóxico-Isquémica.
Por distintos motivos en los últimos años se han buscado alternativas al término EHI como por ejemplo encefalopatía neonatal o acidemia neonatal. Sin embatgo estos términos no son específicos ya que existen muchas causas de encefalopatía neonatal de origen no hipóxica como las encefalopatías epilépticas neonatales o las encefalopatías metabólicas, y muchas causas de acidemia neonatal distintas a la EHI (enfermedades mitocondriales de presentación neonatal para citar un ejemplo). El término encefalopatía hipóxico-isquémica no solo nos denota la existencia del compromiso cerebral (encefalopatía), sino también el origen fisiopatológico del mismo (hipoxia e isquemia) por lo que es el término adecuado para este cuadro.
Fisiopatología:
De los párrafos anteriores se desprende que para que tengamos una encefalopatía hipóxico-isquémica perinatal hay dos condiciones necesarias:
1- Un evento hipóxico-isquémico y,
2- Repercusión cerebral (encefalopatía)
Como dijimos previamente hay encefalopatías neonatales de causa no hipóxico-isquémica y también niños que sufren hipoxia e isquemia al nacer pero no tienen repercusión cerebral (no tienen encefalopatía).
Pero, ¿qué sucede cuando existen ambos componentes?. ¿De qué manera la hipoxia y la isquemia cerebral produce encefalopatía en el recién nacido? La interrupción del intercambio gaseoso que se genera al inicio de la EHI produce disminución de la presión de oxígeno (pO2) y aumento de la presión de dióxido de carbono (pCO2) y caída del pH (Fig. 1).
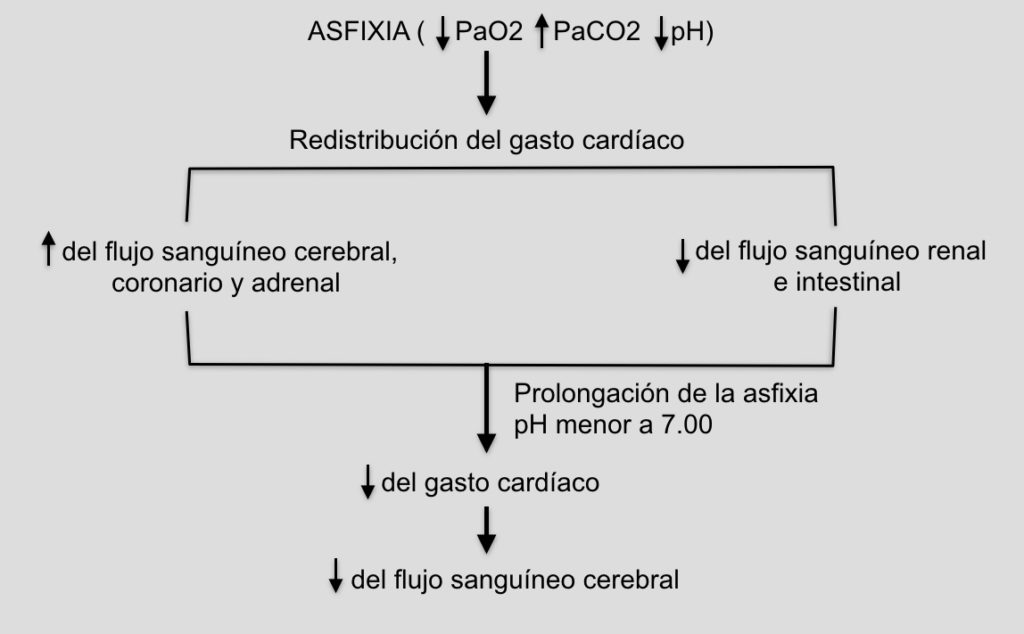
Esto produce una redistribución del gasto cardíaco para priorizar el flujo sanguineo cerebral (mantener las funciones cerebrales), coronario (permitir que el corazón siga bombeando sangre) y adrenal (mantener la respuesta al stress), a costa de bajar el flujo sanguíneo renal e intestinal. El cerebro en esta etapa generará energía con glucólisis anaerobia, o sea a partir de glucosa pero sin oxígeno, lo cual es menos efectivo pero permite mantener algo de producción energética.
Si la hipoxia se prolonga y el consecuencia el pH desciende por debajo de 7.0, el músculo cardíaco pierde contractilidad y el fallo en la función de bomba del corazón lleva aparejado una disminución del flujo sanguíneo cerebral (isquemia).
La isquemia agrega a la falta de oxígeno falta de glucosa lo que empeora todavía más la falla energética.
Pero ¿Por qué es tan importante la producción de energía en este moento?. La energía que se produce en el cerebro en forma de ATP mantiene, entre otras cosas, la función de la bobma Na+/K+ ATPasa, que en condiciones normales de funcionamiento quita Sodio (Na+) de la célula e introduce potasio (K+), como este movimiento iónico se realiza en contra del gradiente natural requiere energía. Al fallar la bomba se acumula sodio en el interior de la neurona y esto atrae agua con el consiguiente edema citotóxico que vamos a ver en la resonancia magnética como positividad en la secuencia de difusión, y en definitiva muerte por necrosis celular. A esta muerte celular temprana se la denomina fallo energético primario (Fig. 2).
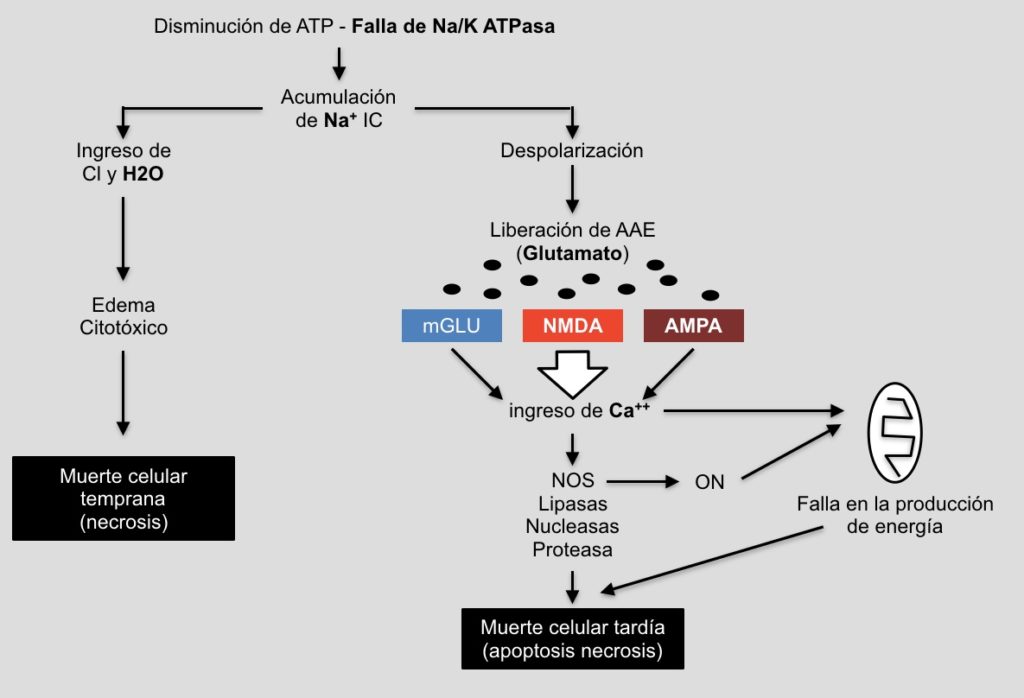
Por otro lado, ese aumento del sodio intracelular va a producir la despolarización de las neuronas y por ende la liberación de neurotransmisores, entre ellos uno de particular importancia: el Glutamato.
Una vez reestablecida la circulación sanguínea y la normal oxigenación, ese exceso de Glutamato liberado por las neuronas despolarizadas va a actuar sobre tres receptores principales: los receptores metabotrópicos de Glutamato, los receptores AMPA y los llamados NMDA. Todos éstos pero principalmente éste último, los receptores NMDA, al activarse por el Glutamato permitirán el ingrso de Calcio (Ca++) a la célula lo que generará una serie de cascadas intracelulares con liberación de óxido nítrico, activación de lipasas, nucleasas y proteasas así como disfunción mitocondrial, y en definitiva la generación de muerte celular por apoptosis además de necrosis. A esta etapa de muerte celular tardía se la denomina falla anergética secundaria.
Entre la falla energética primaria y los eventos que llevan a la falla energética secundaria hay un período de ventana, que mediante investigaciones se ha establecido en 6 hs, durante el cual el inicio de la terapia con hipotermia disminuye el efecto noscivo de la falla energética secundaria.
La importancia de tratar precozmente la EHI cuando se produce radica en que la misma se asocia en una alto porcentaje a distintos tipos de discapacidad, principalmente parálisis cerebral.
Métodos de neuroprotección
La hipotermia terapéutica, ya sea en la modalidad de enfriamiento selectivo de la cabeza mediante uso de cascos o enfriamiento corporal total mediante colchones, se ha mostrado efectiva para disminuir la muerte o discapacidad en niños con encefalopatía moderada o severa secundaria a eventos hipóxico-isquémicos. Si bien los resultados son algo modestos, es la mejor terapia de neuroprotección disponible en la actualidad.
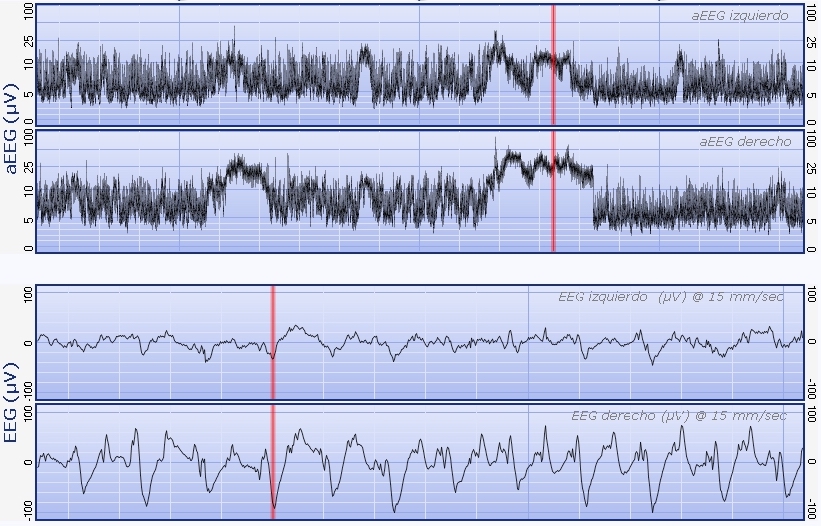
Otra medida fundamental para mejorar el pronóstico de estos niños es el correcto diagnóstico y tratamiento de las convulsiones que se producen durante el período agudo de la EHI. Es bien sabido que las convulsiones que se producen en el cerebro isquémico durante la etapa aguda generarán mayor daño. La dificultad principal en este punto radica en que el porcentaje de crisis epilépticas sin sintomatología visible (crisis subclínicas) o con mínimos síntomas en esta población es enorme, hasta del 50% a 80% de las crisis pueden no tener signos visibles, especialmente en niños tratados con anticonvulsivantes, sobre todo con Fenobarbital. Por este motivo la correcta utilización del monitor electroencefalográfico integrado por amplitu (aEEG) es fundamental al permitir diagnosticar y tratar crisis subclínicas en el momento en que se producen. Para lograrlo todo el plantel de neonatología, médicos de staff, enfermeros neonatales y médicos de guardia, deben entrenarse en la interpretación del monitor para poder reconocer las crisis epilépticas cuando se estan produciendo.
Otros medidas neuroprotectoras continúan en estudios o se están implementando de a poco, muchas de ellas para sumar al tratamiento de hipotermia o como método de neuroprotección independiente. Algunos de estos agentes neuroprotectores son la Eritropoyetina, la Melatonina, el Xenon, el Sulfato de magnesio, la N-Acetil-cisteína o el Alopurinol entre otros.
Más allá de todos los esfuerzos de investigación en curso y los múltiples agentes neuroprotectores disponibles o en estudio no hay que olvidar que el control de la oxigenación, la glucemia y la tensión arterial, así como evitar la hipertermia y el correcto manejo de las convulsiones neonatales, que son parte de los cuidados habituales del recién nacido que se encuentra en una unidad de cuidados intensivos neonatales, son fundamentales para disminuir el daño cerebral del neonato con lesión hipóxico-isquémica.
Autor: El Dr. Sebastián Gacio es Neurólogo infantil y neonatal del Hospital de Niños Ricardo Gutiérrez de la ciudad de Buenos Aires.
Texto original escrito para el Foro Académico de Neurología Neonatal el 18 de Julio de 2020. neurologianeonatal.com
