A continuación transcribo un texto sobre IRM en EHI que escribí recientemente para el grupo de trabajo de encefalopatía hipóxico-isquémica de la SAP. Es un pequeño aporte a un trabajo monumental del que participan médicos, enfermeros y otros profesionales de la salud que se dedican al cuidado de neonatos y su familia.
Estudio del sistema nervioso central con imágenes de resonancia magnética (IRM)
Dr. Sebastián Gacio
Introducción
Las imágenes de resonancia magnética (IRM) cerebral son el método de elección para evaluar lesiones hipóxico-isquémicas neonatales debido a la gran definición de imagen y a la ausencia de radiación. Su utilización en neonatos con EHI tratados con hipotermia ha aumentado en forma constante debido su valor pronóstico y a su capacidad de mostrar lesiones específicas de encefalopatía hipóxico-isquémicas (EHI) y de otras etiologías facilitando el proceso diagnóstico.
Se han propuesto diferentes clasificaciones de los hallazgos de las IRM en recién nacidos con EHI pero todas ellas se basan principalmente en los distintos tipos de lesión que se puede observar según la severidad y duración del evento isquémico en niños de término o casi término (1,2,3,4).
Áreas afectadas según tipo de evento
Las áreas cerebrales lesionadas en recién nacidos con encefalopatía hipóxico-isquémica dependerán de la edad gestacional del niño y de la gravedad y duración del evento hipóxico-isquémico.
Cuando la isquemia es severa pero de breve duración las áreas más afectadas serán las que, por estar en prceso de mielinización, tienen la tasa metabólica más alta y por ende el mayor consumo de oxígeno y glucosa. En niños nacidos de término éstas áreas son principalmente los ganglios basales, el tálamo, la corteza peri-rolándica y el brazo posterior de la cápsula interna. Otras áreas afectadas son los hipocampos, áreas dorsales del tronco encefálico y superiores del vermis cerebeloso. A este tipo de lesión se la denomina patrón central de ganglios basales y tálamos (GBT) y suele asociarse a parálisis cerebral principalmente disquinética, asociado a compromiso cognitivo en los casos severos (2, 5).
Cuando la isquemia es menos severa pero sostenida en el tiempo las áreas afectadas son las llamadas áreas limítrofes de circulación, que son las áreas cerebrales que reciben circulación de las ramas terminales de las grandes arterias. Estas lesiones se producen por la disminución sostenida del flujo sanguíneo en esos vasos terminales. Este tipo de lesión afecta la sustancia blanca subcortical parasagital y áreas de sustancia blanca y corteza frontal y parieto-occipital (áreas terminales de circulación de arterias cerebral media y anterior y arterias cerebral media y posterior respectivamente) con compromiso frecuente del cuerpo calloso. Este patrón es denominado lesión de áreas limítrofes y su relación a parálisis cerebral dependerá de su extensión. En los casos severos el compromiso de sustancia blanca y corteza cerebral genera parálisis cerebrales frecuentemente asociadas a comorbilidad epiléptica y cognitiva. Sin embargo en los casos de mínimo compromiso pueden verse solo lesiones puntiformes peri-ventriculares en dichos territorios, siendo el pronóstico favorable (2, 5).
Por último, si la isquemia es severa y a la vez prolongada se produce una combinación de ambos patrones (central y limítrofe) con compromiso difuso de los hemisferios cerebrales, tanto de la sustancia blanca como de la corteza, y los núcleos profundos, dando en los casos más graves un patrón de lesión llamado lesión difusa o cerebro blanco. Este tipo de lesión suele evolucionar en la mayoría de los casos a encefalomalacia multiquística y parálisis cerebral cuadriparética espástica severa (2).
Todos estos patrones de lesión están directamente relacionadas a la fisiopatología de la isquemia cerebral desencadenada por el evento hipóxico-isquémico, pero también podemos encontrar otros hallazgos como hematomas subdurales o extradurales, lesiones isquémicas focales o hemorragias parenquimatosas y trombosis de senos venosos entre otros.
En niños nacidos pretérmino el patrón central comprometerá las mismas estructuras que en el niño de término a excepción del brazo posterior de la cápsula interna, la corteza peri-rolándica y el vermis cerebeloso debido a que aún no iniciaron su proceso de mielinización (6). Los casos de isquemia leve-moderada y prolongada, más frecuentes en niños prematuros, lesionarán la sustancia blanca periventricular dando la típica imagen de leucomalacia periventricular.
Interpretación de los patrones de lesión en las distintas secuencias de IRM
Como se dijo en los párrafos anteriores en niños nacidos a término o casi término que sufren EHI podemos encontrar cuatro patrones principales de lesión:
- Lesiones puntiformes periventriculares (LPP)
- Lesión de áreas limítrofes (AL)
- Lesión central de ganglios basales y tálamo (GBT)
- Lesión difusa o cerebro blanco (LD)
La ausencia de mielina en el cerebro neonatal hará que la sustancia blanca se vea hipointensa en T1 (Figura A) e hiperintensa en T2 (Figura B), pero a la edad de término el brazo posterior de la cápsula interna estará en proceso de mielinización, por lo que se verá hiperintenso en T1 (flecha en Figura A) e hipointenso en T2 (flecha en Figura B), al igual que el putamen posterior, el tálamo ventro-lateral, la corteza peri-rolándica y la porción dorsal del tronco encefálico.
En las lesiones centrales de ganglios basales y tálamos (Fig C y D) se comprometen en primer lugar las áreas que están mielinizando por lo que veremos dichas áreas hiperintensas en T1 pero con una extensión que excede las áreas de mielinización normales (flechas en Figura C) y a la vez observaremos la pérdida de la intensidad normal en T2 (Figura D). Por ejemplo la ausencia de visualización del brazo posterior de la cápsula interna es un signos objetivo de lesión central (figura D, comparar con figura B).
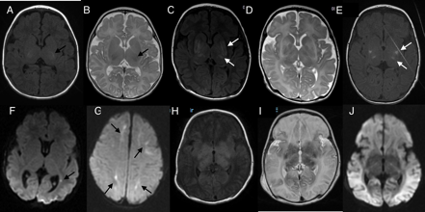
La lesión de GBT puede ser sub-diagnosticadas con la técnica de difusión (5). Cuando hay dudas respecto a la existencia de lesión en ganglios basales y tálamos la realización de una nueva IRM entre los días 14 y 21 de vida puede mejorar el rédito diagnóstico mostrando la lesión isquémica ya claramente establecida (Figura E).
Otras áreas afectadas en este tipo de lesión y que tendrán difusión positiva (brillante) con caída del ADC (oscuro) si la IRM se realiza dentro de los primeros 7 días desde el evento isquémico son la corteza peri-rolándica, los hipocampos, el tronco posterior y el vermis cerebeloso.
El segundo patrón de lesión es el de las lesiones puntiformes peri-ventriculares (figura F) y las lesiones en áreas limítrofes (figura G), que se asocian a eventos isquémicos leves a moderados pero prolongados. Estas lesiones son hiperintensas en T1 y tendrán difusión positiva si la IRM se realiza dentro de los 7 días del evento isquémico (flechas en figuras F y G). Las lesiones de áreas limítrofes que comprometen la corteza cerebral se verán como una pérdida de la normal diferenciación de la sustancia gris y blanca tanto en T1 como en T2.
Las lesiones difusas se ven en T1 (figura H) y T2 (figura I) como una pérdida de la normal diferenciación de la sustancia gris y blanca de los hemisferios cerebrales (similar a las lesiones limítrofes extensas) sumado a la visualización de la lesión de ganglios basales y tálamo similar a la de las lesiones centrales. En la secuencia de difusión se observa restricción en la totalidad del cerebro por lo que a esta lesión se la describe como cerebro blanco (figura J).
Elección del protocolo adecuado de imágenes
La elección de las secuencias a la hora de realizar una IRM es fundamental para un resultado óptimo. La técnica de difusión y ADC (apparent diffusion coefficient) tienen mejor sensibilidad para la observación de lesiones isquémicas en comparación con las secuencias convencionales (T1 y T2), pero son positivos solo los primeros 7 días posteriores al evento isquémico y hasta alrededor del día 10 en niños tratados con hipotermia (7). A partir de ese momento, las lesiones deberán evaluarse en las secuencias convencionales, lo que en ocasiones requiere gran experiencia del observador. En las primeras 48 h luego del evento hipóxico-isquémico, la secuencia de difusión puede ser negativa y, en ese caso, la única anomalía visible será la presencia de ácido láctico en la espectroscopia.
Otras secuencias de utilidad son el gradiente de eco (GRE) o las imágenes de susceptibilidad, ambas sensibles para la visualización de productos de degradación de la hemoglobina y por lo tanto útiles para observar lesiones hemorrágicas que pasarían desapercibidas en las secuencias convencionales.
Un protocolo neonatal básico pero completo debería contar con secuencias T1, T2, Difusión (con ADC), y GRE o imágenes de susceptibilidad.
La IRM cerebral debería realizarse en un resonador de 1,5 tesla, idealmente, entre el día 4 y 7 de vida para obtener rédito de la secuencia de difusión y ya habiendo finalizado el tratamiento de hipotermia con el niño estable y trasladable.
La repetición del estudio entre el día 14 y 21 de vida puede ser de utilidad para visualizar las lesiones ya establecidas en T1 y T2, especialmente para evaluar compromiso de ganglios basales y tálamo.
La IRM puede realizarse mediante inducción del sueño con hidrato de cloral para evitar la anestesia general colocando al niño en forma confortable y contenido para evitar movimientos y con protección auricular, sobre todo la IRM precoz al finalizar la hipotermia. Esto puede ser más difícil a los 14-21 días estando el niño más reactivo.
Bibliografía
1- Twomey E, Twomey A, Ryan S et al (2010) MR imaging of term infants with hypoxic-ischaemic encephalopathy as a predictor of neurodevelopmental outcome and late MRI appearances. Pediatr Radiol 40:1526–1535
2- Rutherford M, Srinivasan L, Dyet L et al (2006) Magnetic resonance imaging in perinatal brain injury: clinical presentation, lesions and outcome. Pediatr Radiol 36:582–592
3- Barkovich AJ, Westmark K, Partridge C et al (1995) Perinatal asphyxia: MR findings in the first 10 days. AJNR Am J Neuroradiol 16:427–438
4- Shankaran S, Barnes PD, Hintz SR, Laptook AR, Zaterka-Baxter KM, McDonald SA, et al. Arch Dis Child Fetal Neonatal Ed. 2012 Nov;97(6):F398-404. doi: 10.1136/archdischild-2011-301524. Erratum in: Arch Dis Child Fetal Neonatal Ed. 2014 Mar;99(3):301. PMID: 23080477; PMCID: PMC3722585.
5- Rutherford M, Biarge MM, Allsop J, Counsell S, Cowan F. MRI of perinatal brain injury. Pediatr Radiol. 2010 Jun;40(6):819-33. doi: 10.1007/s00247-010-1620-z. Epub 2010 Apr 30. PMID: 20432000.
6- Badve CA, Khanna PC, Ishak GE. Neonatal ischemic brain injury: what every radiologist needs to know. Pediatr Radiol. 2012 May;42(5):606-19. doi: 10.1007/s00247-011-2332-8. Epub 2012 Jan 17. PMID: 22249600.
7- Bednarek N, Mathur A, Inder T, Wilkinson J, Neil J, Shimony J: Impact of therapeutic hypothermia on MRI diffusion changes in neonatal encephalopathy. Neurology 2012; 78: 1420–1427.
